Gaya antar molekul adalah gaya tarik-menarik antar molekul yang
saling berdekatan. Gaya antar molekul berbeda dengan ikatan kimia. Ikatan kimia, seperti ikatan
ionik, kovalen, dan logam, semuanya adalah ikatan antar atom dalam
membentuk molekul. Sedangkan gaya antar
molekul adalah gaya tarik antar molekul. Kita akan mempelajari tiga macam gaya antar molekul, yaitu:
·
Gaya Van der Waals
·
Ikatan Hidrogen
·
Gaya London
Agar dapat memahami
gaya antar molekul dengan baik. kita harus memahami terlebih dahulu tentang apa
yang dimaksud dengan dipol dalam suatu molekul.
Dipol
Dipol adalah singkatan dari di polar, yang artinya dua kutub. Senyawa yang memiliki dipol adalah senyawa yang
memiliki kutub positif (δ+) di satu sisi, dan kutub negatif (δ-) di sisi yang lain. Senyawa yang memiliki dipol
biasa disebut sebagai senyawa polar. Senyawa
polar terbentuk melalui ikatan kovalen polar. Perlu diperhatikan bahwa dipol
berbeda dengan ion. Kekuatan listrik yang dimiliki dipol lebih lemah dibanding
kekuatan listrik ion. Kita pasti ingat, bahwa ion terdapat pada senyawa ionik,
dimana molekul terbagi menjadi dua , yaitu ion positif/kation (+) dan ion negatif/anion (-).
Untuk
memahami perbedaan antara ion dan dipol, mari kita perhatikan
gambar berikut:
Dari gambar di atas
dapat dilihat bahwa pada senyawa ion, molekul terbagi (bisa juga dikatakan
terbelah) menjadi dua bagian. Jadi ion positif dan ion negatif sebenarnya
terpisah. Mereka bersatu hanya karena adanya gaya tarik-menarik antar ion
positif dan negatif (gaya coulomb).
Pada senyawa polar,
tidak terjadi pemisahan. Molekul merupakan satu kesatuan. Hanya saja pada satu
sisi/tepi terdapat kutub positif (δ+) dan di sisi/tepi yang lain
terdapat kutub negatif (δ-).
Untuk senyawa non polar, sama sekali tidak ada muatan listrik yang terkandung.
Untuk senyawa non polar, sama sekali tidak ada muatan listrik yang terkandung.
Untuk mempelajari
bagaimana dipol terbentuk, silakan tengok kembali materi ikatan kovalen polar di kelas X.
Gaya Van der Waals
(Gaya tarik antara dipol-dipol)
Gaya Van der Waals
merupakan gaya tarik antar dipol pada molekul polar. Molekul polar memiliki ujung-ujung yang muatannya
berlawanan. Ketika dikumpulkan, maka molekul polar akan mengatur dirinya
(membentuk formasi) sedemikian hingga ujung yang bermuatan
positif akan berdekatan dengan ujung yang bermuata negatif dari molekul lain.
tapi tentu saja formasinya tidak statis/tetap, kenapa? Karena sebenarnya
molekul selalu bergerak dan bertumbukan/tabrakan.
Catatan:
Molekul/atom/zat akan diam tak bergerak jika energi kinetiknya = 0 (nol). Keadaan ini disebut keadaan diam mutlak, dicapai jika benda berada pada suhu 00K (-2730C)
Molekul/atom/zat akan diam tak bergerak jika energi kinetiknya = 0 (nol). Keadaan ini disebut keadaan diam mutlak, dicapai jika benda berada pada suhu 00K (-2730C)
Untuk jelasnya, bisa
dilihat pada gambar berikut:
Gaya Van der Waals diperlihatkan dengan garis
merah (putus-putus). Kekuatan gaya tarik antara dipol ini biasanya lebih lemah
dari kekuatan ikatan ionik atau kovalen (kekuatannya hanya 1% dari ikatan).
Kekuatannya juga akan berkurang dengan cepat bila jarak antar dipol makin
besar. jadi gaya Van der Waaals suatu molekul akan lebih kuat pada fase padat
dibanding cair dan gas.
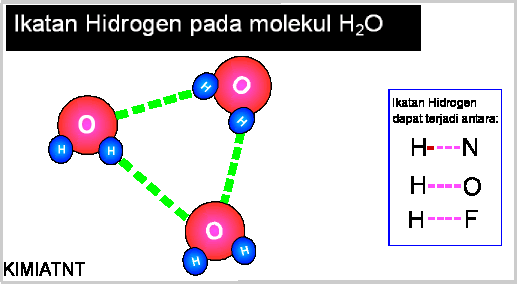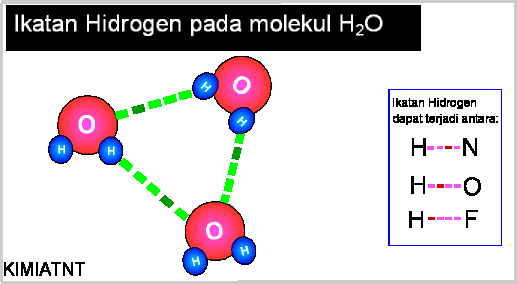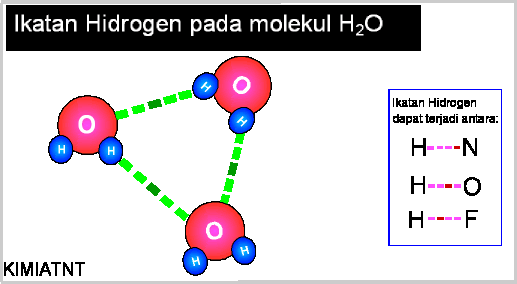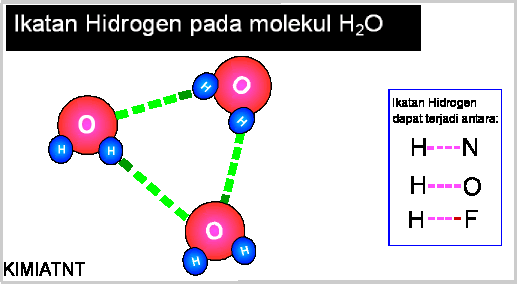
Ikatan hidrogen adalah
ikatan yang terjadi antara atom hidrogen pada satu molekul dengan atom nitrogen
(N), oksigen (O), atu fluor (F) pada molekul yang lain. Gaya tarik dipol yang
kuat terjadi antara molekul-molekul tersebut. Gaya tarik antar molekul yang
terjadi memiliki kekuatan 5 sampai 10% dari ikatan kovalen. Gambaran ikatan
hidrogen dapat dilihat pada gambar berikut:
Ikatan hidrogen
diperlihatkan pada garis merah (putus-putus). Meskipun tidak terlalu kuat,
ikatan hidrogen tersebar diseluruh molekul. Inilah sebabnya air (H2O)
memiliki titik didih yang relatif lebih tinggi bila dibandingkan
dengan senyawa lain dengan berat molekul (Mr) yang hampir sama. Sebut misalnya
CO2 (Mr=48) dalam suhu
kamar sudah berwujud gas, sedangkan air (H2O)
dengan berat molekul lebih kecil (Mr=18) pada suhu kamar (20 0C) masih berada pada fase cair.
Gaya London
Gaya London merupakan
gaya antar dipol sesaat pada molekul non polar. Seperti kita ketahui molekul non polar seharusnya
tidak mempunyai kutub/polar (sesuai dengan namanya). Namun, karena adanya pergerakan
elektron mengelilingi atom/molekul, maka ada saat-saat tertentu dimana elektron
akan "berkumpul" (terkonsentrasi) di salah satu ujung/tepi molekul,
sedang di tepi yang lain elektronnya "kosong". Hal ini membuat
molekul tersebut "tiba-tiba" memiliki dipol, yang disebutdipol
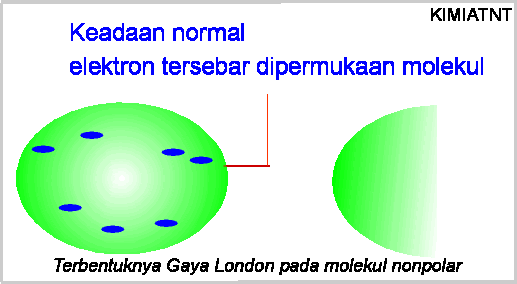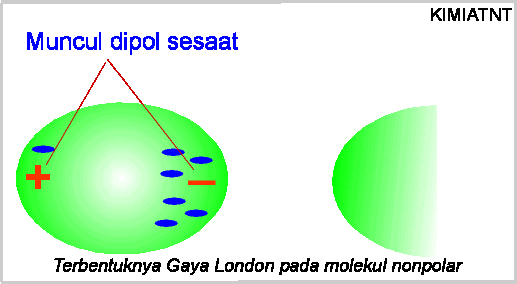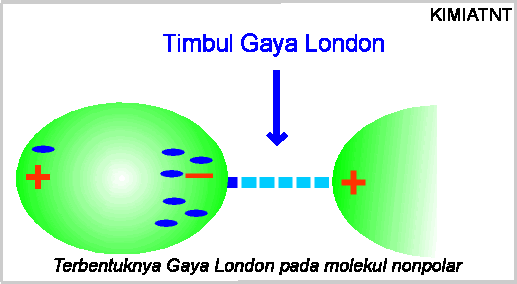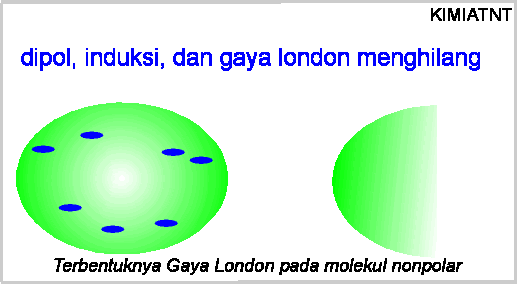
sesaat. Munculnya dipol ini akan menginduksi dipol tetangga disebelahnya. Ketika elektron
bergerak lagi, dipol ini akan hilang kembali. Untuk jelasnya dapat dilihat pada
gambar berikut:
Ketika dipol sesat terjadi, akan timbul pula gaya london (garis biru putis-putus).
Ketika dipol hilang, gaya london pun hilang. Kekuatan Gaya london bergantung
pada berbagai faktor:
1.
|
Kerumitan
molekul
makin rumit molekul (Mr makin besar), maka gaya london makin kuat. |
2.
|
Ukuran
molekul
makin besar ukuran molekul, gaya london juga makin kuat. hal ini dikarenakan molekul besar lebih mudah terpolarisasi, sehingga dipol sesaat lebih mudah terjadi. |
Ringkasan
1.
Gaya antar molekul
adalah gaya tarik antar molekul-molekul yang berdekatan.
2.
Gaya antar molekul
pada umumnya merupakan gaya tarik listrik statis (elektrostatik) antara muatan
positif (+) dan negatif(-).
3.
KIta mengenal tiga
jenis gaya antar molekul, yaitu: gaya van der waals, ikatan hidrogen, dangaya london.
4.
Ikatan hidrogen terjadi antara atom hidrogen (H) dengan atom: nitrogen (N), oksigen (O), atauFluor (F).
5.
Gaya van der waals adalah gaya tarik elektrostatis pada senyawa ionik atau kovalen polar.
6.
Gaya london adalah gaya tarik elektrostatis pada senyawa kovalen non polar.

Tidak ada komentar:
Posting Komentar